|
|
本帖最后由 Rex 于 2022-10-10 14:57 编辑
为了保证药品的安全性、有效性和质量可控性,国际间各国不论是审查标准或GMP核查制度,都是在不断提升及强化对药品品质的管理,其中,原料药(Active pharmaceutical ingredients, API)的品质管控是非常重要的一环。
一、我国现行原料药管理制度——关联审评审批制度
2017年以前,我国对原料药一直实施注册许可制度。为了深化审评审批制度改革鼓励药品创新,2017年10月8日,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》作为原料药、药用辅料和包装材料(以下简称“原辅包”)改革制度的起点,正式规定实行药品与药用原辅料和包装材料关联审批。(1)2017年11月23日,原国家食品药品监督管理总局发布《关于调整原料药、药用辅料和药包材审评审批事项的公告》(国家食品药品监督管理总局2017年第146号,以下简称“146号文”),明确各级食药监部门不再单独受理原料药注册申请,改为与关联药品制剂注册时一并关联审评。药审中心建立原料药登记平台,除药品制剂申请人自用或者专供的原料药之外,均应进行登记。(2)自此,我国原料药由单独的注册许可制改为药品关联审评审批登记制。
2019年7月15日,国家药品监督管理局发布《关于进一步完善药品关联审评审批和监管工作有关事宜的公告》(国家药品监督管理局公告2019年第56号,以下简称“56号文”),在146号文基础上进行细化及调整,允许仿制或进口境内已上市药品制剂所用的原料药进行单独审评审批,以缓解原料药供需矛盾。此外,56号文明确了已有批文的原辅包登记状态自动转化为“A”的政策。(3)2019年8月26日,全国人大常委会发布《药品管理法》,规定国务院药品监督管理部门在审批药品时,对化学原料药一并审评审批。
2020年1月22日,国家市场监督管理总局发布《药品注册管理办法》和《药品生产监督管理办法》(国家市场监督管理总局令第27号、第28号,以下分别简称“27号令”、“28号令”),规定自2020年7月1日起,国家明确建立关联审评审批制度。国家药品监督管理局在审评审批药品制剂时,对化学原料药一并审评审批。(4)仿制境内已上市药品所用的化学原料药(以下简称“仿制化学原料药”)可申请单独审评审批。(5)申请关联审评审批的,批准后的原料药不得委托生产(6)。
综上所述,我国化学原料药仍为行政许可,实行审评审批制度。原料药和制剂关联审评,仿制化学原料药可以选择单独审评审批。针对原料药可否委托生产,业内普遍持消极态度。虽然专家在进行相关答疑时认为,不能片面理解原料药不得委托生产,需要注意前提条件。注册办法中允许原料药前置登记,或者与制剂一同申报。但专家也同样指出,对于创新药的上市许可持有人来说,与制剂一同申报是首选路径,应当按照规定提交申报资料,且批准后的原料药不能再行委托生产。 (7)结合最新法律规定以及专家答复,我国现行原料药管理制度下,仅仿制化学原料药可申请单独审评审批,经批准后,该原料药应当由原料药生产企业自行生产,不得委托生产。申请关联审评审批的仿制化学原料药以及创新药的原料药,经关联审评审批后,不得再行委托他人生产。
二、美国原料药管理制度——DMF制度
根据美国《联邦法规》(Code of Federal Regulation, CFR)第210条、第211条规定,任何进入美国市场的药品(包括原料药)都须向美国食品药品管理局(FDA)申请注册,并递交相关资料档案。 (8)美国于1989年推动DMF(Drug Master Files,药物主文件)审查制度,除原料药外,辅料、药包材等都能以DMF送件审查。2012年美国推动仿制药收费法案(Generic Drug User Fee Act,GDUFA),将原料药技术文件管理进一步与制剂管理同步,要求文件的审查、维持与变更等须持续与使用该原料药的制剂动态管理一致,使品质管制技术文件更具完整性(9)。
DMF(药物主文件)是呈交FDA的存档待审资料,资料内容包括有关在制造、加工、包装、储存、批发人用药品活动中所使用的生产设施、工艺流程、质量控制及其所用原料、包装材料等详细信息。DMF作为一种参阅性资料在FDA中心档案室存档,用于一种或多种临床研究申请(Investigational New Drug Application, IND)、创新药申请(New Drug Application, NDA)、仿制药/简化新药申请(Abbreviated New Drug Application, ANDA)、出口申请、以及上述各种申请的修正和补充(10)。
DMF持有者向FDA呈交DMF主要目的是支持用户向FDA提交的各种药品申请,而同时又不愿将其化学和生产流程的保密资料抄报用户。FDA对呈交的DMF资料进行存档处理,以备审查。这样,DMF持有者只需向用户提供授权书,授权FDA在评审用户的药品申请时,对所涉及的DMF进行全面考查。DMF资料上交后,FDA仅做形式审查,而不实质审批。只有当DMF的用户向FDA申报制剂药品申请(IND、NDA、ANDA)及其修正或补充后,FDA才开始审查DMF资料是否符合FDA的安全性及其他要求。
FDA对收到的DMF文件会按季度进行归档汇总,合并到一个总目录(DMF LIST)(11)之中。截止2020年6月30日,FDA归档的DMF文件数目为34984个。DMF文件共有5种类型,见表1。

以上5种类型文件中,2000年1月12日后,FDA不再接收第I类DMF文件,而第V类DMF文件递交前其具体内容须同FDA提前沟通。(12)其中第II类原料药物DMF是DMF文件的主体,在所有归档的DMF文件中,其比例在70%左右(13)。
三、欧洲原料药管理制度——CEP认证和ASMF制度
根据欧盟于2012年修订的2001/83/EC指令以及2011/62/EC指令(14)规定,自2013年7月2日起,任何输入欧盟的原料药均须随货检附输出国卫生主管机关出具的“证明文件 (Written Confirmation)”,以证明该原料药的品质。有关欧盟的DMF有两种申请方式:
1. 若原料药已收录于《欧洲药典》中,则原料药生产企业可以自行申请,经由欧洲药品质量管理局(EDQM)核准后,发予欧洲药典适应性证书(Certificate of suitability to the monographs of the European Pharmacopoeia, CEP),证明原料药的品质是按照欧洲药典有关规定严格管控(15)。
2. 若原料药尚未收录于《欧洲药典》中,则原料药生产企业须配合制剂企业,递送欧盟各国的ASMF(Active Substance Master File,原名为EDMF)。ASMF只能在制剂药品上市许可申请时递交,并且只有欧盟成员国内的药品制造企业及其授权代表(例如当地进口商)可以提出(16)。
欧洲CEP证书申请档案强调原料药本身的性质,包括活性药物成分本身的化学结构及结构解析、理化性质、质量标准、分析方法、杂质及其限度、稳定性考察等。原料药生产企业为取得该证书,需提交一份详细档案(All in one),其中可能包含机密资料。同时生产企业须承诺该产品生产严格遵循GMP标准,且须通过档案的审查与现场审查后方可获得该证书。
ASMF是药品制剂企业为取得上市许可而必须向注册当局提交有关制剂产品中使用的原料药的基本情况的支持性技术档案。ASMF的申请必须与使用该原料药的制剂的上市许可申请同时进行。当原料药的生产企业(Active Substance Manufacturer,ASM)不是药品制剂上市许可证的申请人时,为了保护原料药的生产与品质管制相关的技术性资料,由原料药生产企业直接提交档案给欧洲药品审评管理局(EMA)。档案分为公开部分(Applicants Part, AP)和保密部分(Restricted Part, RP),前者需要提交给制剂用户作为其上市许可申请文件的一部分,而后者则直接提交给药政机构。这种方式既使制剂上市许可持有人作为药品质量的责任人能够了解原料药质量控制的必要信息,又可以保护原料药生产企业的技术机密。
四、原料药管理制度比较
国际间原料药管理模式、文件格式要求与审查标准已渐趋一致,如多数国家或地区都要求原料药技术资料以DMF递送后,须配合制剂药品上市申请时才进行审查等。以下对美国DMF制度、欧盟ASMF制度和中国关联审评审批制度进行比较:
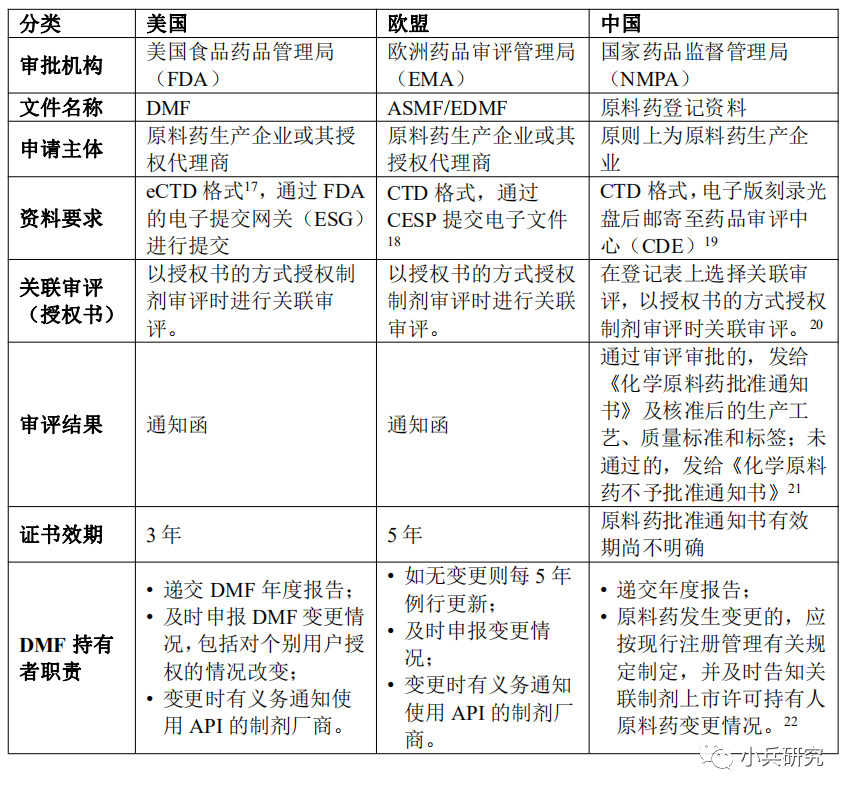
五、结论
在药品管理的发展历程中,各国皆有其独特的历史。在法规与国际接轨的过程中,我国原料药管理同样面临各种挑战。虽我国原料药管理制度仍有待改善,但基本管理理念已与国际趋于一致,如对于原料药登记资料采行CTD格式,参考ICH规范为审查标准等。审批制度方面我国原料药仍为行政许可审评审批制,对于通过技术审评的给予批准通知书,原料药实际与药品制剂处于近似对等地位。对于原料药生产企业而言,NMPA允许仿制原料药单独审评审批,使得原料药生产企业更握有主动权,该等企业应抓住机会,积极主动的优化原料药合成工艺,加快完善品种布局。对于药品制剂持有人而言,持有人是药品生命周期责任主体,需有效监管所选择的原辅包,如因违法违规使用原辅包产品引发的制剂质量问题,持有人将承担全部责任。
目前尚未正式出台的《化学原料药、药用辅料及药包材与药品制剂关联审评审批管理规定(征求意见稿)》对原辅包企业的责任与义务、登记范围、变更的相关程序、登记缴费程序、原料药关联审评审批与单独审评审批程序及时限等予以明确规定。但其中的部分条款仍存在争议,如规定相同原理的生产工艺生产的同种原料药应选择最优工艺进行登记,但未明确如对于同一原料药客户需求不同时应作何处理。期待未来该具体操作规范能尽快正式落地,以推进关联审评审批制度不断发展完善。
(1) 《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》第十二条。
(2) 146号文第二、八条。
(3) 56号文第七、八、九、十一条。
(4) 《药品注册管理办法》第十四条规定:“国家药品监督管理局建立化学原料药、辅料及直接接触药品的包装材料和容器关联审评审批制度。在审批药品制剂时,对化学原料药一并审评审批,对相关辅料、直接接触药品的包装材料和容器一并审评。”
(5) 《药品注册管理办法》第四十三条规定:“仿制境内已上市药品所用的化学原料药的,可以申请单独审评审批。”
(6) 《药品生产监督管理办法》第四十二条规定:“经批准或者通过关联审评审批的原料药应当自行生产,不得再行委托他人生产。”
(7) 参考《药品注册管理办法》《药品生产监督管理办法》热点问题专家答疑(六),http://www.cnpharm.com/c/2020-05-06/726032.shtml。
(8) CFR - Code of Federal Regulations Title 21, Part 210 & Part 211,
https://www.accessdata.fda.gov/s ... rch.cfm?CFRPart=210, https://www.accessdata.fda.gov/s ... earch.cfm?fr=211.1.
(9) U.S. FDA CDER and CBER. 2012. Guidance for Industry Initial Completeness Assessments for Type II API DMFs Under GDUFA, https://www.fda.gov/media/84217/download.
(10) Drug Master Files (DMFs),
https://www.fda.gov/drugs/forms- ... -master-files-dmfs.
(11) List of Drug Master Files (DMFs), https://www.fda.gov/drugs/drug-m ... -master-files-dmfs.
(12) Federal Register Volume 65, Issue 8 (January 12, 2000), https://www.govinfo.gov/app/details/FR-2000-01-12/00-648/summary.
(13) 同上。
(14) Directive 2011/62/EU of the European Parliament and of the Council of 8 June 2011 amending Directive 2001/83/EC on the Community code relating to medicinal products for human use, as regards the prevention of the entry into the legal supply chain of falsified medicinal products Text with EEA relevance, https://eur-lex.europa.eu/legal- ... celex%3A32011L0062.
(15) EDQM, Certification of suitability to the monographs of the European Pharmacopoeia, December 2018,
https://www.edqm.eu/sites/defaul ... _november_2018.pdf.
(16) EMA, Active Substance Master File Procedure, https://www.ema.europa.eu/en/act ... ter-file-procedure.
(17) CTD文件(药品注册通用技术文件)是国际公认的文件编写格式,用来制作一个向药品注册机构递交的结构完整的注册申请文件。
(18) Certification of suitability to the Monographs of the European Pharmacopoeia- Use of CESP to submit electronic documents to EDQM,
https://www.edqm.eu/sites/default/files/pa_ph_cep_13_67_2r.pdf.
(19) 《化学原料药、药用辅料及药包材与药品制剂关联审评审批管理规定(征求意见稿)》第十五条。
(20) 《化学原料药、药用辅料及药包材与药品制剂关联审评审批管理规定(征求意见稿)》第七条、附件1-1。
(21) 《化学原料药、药用辅料及药包材与药品制剂关联审评审批管理规定(征求意见稿)》第二十二条。
(22) 《化学原料药、药用辅料及药包材与药品制剂关联审评审批管理规定(征求意见稿)》第十一条、第十二条。
|
|